FDA宣布美国首个基因疗法获批用于癌症治疗
FDA announces first US gene therapy approval for cancer treatment
美国食品和药物管理局( FDA)批准了一种新的白血病治疗方法,该机构将其视为已明确批准在美国市场上投放市场的首个基因治疗方法。
这种称为Kymriah的疗法旨在在一线药物治疗失败后为某些患者提供第二次机会。根据FDA的说法,多达五分之一的患者可能会发生这种情况。
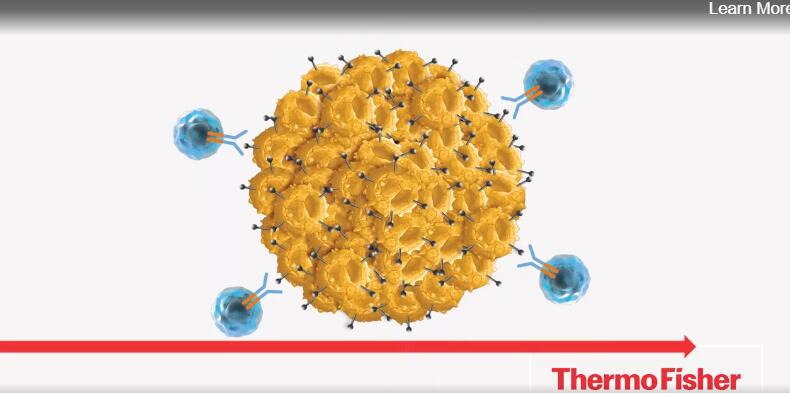
每个剂量的Kymriah都包含患者自身的免疫细胞,这些免疫细胞被送往实验室进行病毒基因改造。这种疗法-称为嵌合抗原受体T细胞疗法或CAR-T-使细胞能够识别并杀死癌症的来源。
FDA专员斯科特·戈特利布(Scott Gottlieb)博士在一份声明中说: “我们正在进入医疗创新的新领域,它具有对患者自身细胞进行重编程以攻击致命癌症的能力。”
费城儿童医院癌症免疫疗法主任史蒂芬·格鲁普博士说:“我们从未见过这样的事情,我相信这种疗法可能成为该患者群体的新护理标准。”
FDA咨询委员会已建议该疗法在7月份获得批准,以治疗被称为B细胞急性淋巴细胞白血病或ALL的血液癌症的复发。
根据现有数据,接受该治疗的患者存活至少六个月的机率为89%,存活至少一年的机率为79%,大多数患者在那时均无复发。
根据美国疾病控制与预防中心的数据,2014年将近5,000人被诊断出患有ALL。一半以上是儿童和青少年。美国国家癌症研究所称,ALL是儿童中最常见的癌症类型。
大多数ALL患者可以通过其他治疗方法恢复,例如放射,化学疗法和干细胞。但是,如果癌症复发,则预后很差。
制作Kymriah的制药公司诺华在一份声明中说:“迫切需要新颖的治疗选择,以改善复发或难治性B细胞前体ALL患者的预后。”
FDA生物制品评估与研究中心主任Peter Marks博士说:“ Kymriah是一种首创的治疗方法,可满足患有这种严重疾病的儿童和年轻人的重要未满足需求。” 。
一次性治疗对细胞因子释放综合征或CRS发出有框的警告,这是威胁生命的副作用,可导致血压降低到危险的程度。它是由过度活跃的转基因免疫细胞引起的。FDA说,医院和诊所必须获得分发药物的认证,这意味着它们准备识别和治疗CRS和其他可能致命的神经系统事件。诺华制药公司表示,希望在一个月内建立起由20个治疗中心组成的初始网络,并计划在今年年底之前将其扩展到32个。
Kymriah的价格为$ 475,000;但是,根据诺华公司的说法,在治疗后一个月内没有反应的患者将不收费。
“ Novartis正在与(医疗补助服务中心)合作,提供一种基于结果的方法,仅在小儿和年轻成人ALL患者在第一个月末对Kymriah做出反应时才允许付款。未来的潜在适应症将在最相关的基于结果的方法,”该制药公司在一份声明中说。
星期三,FDA还扩大了另一种药物tocilizumab的批准范围,以治疗2岁及2岁以上的患者的CRS。
在七月份告知咨询委员会决定的主要研究中,约有68名患者中有一半经历了高级CRS,尽管没有人因此死亡。经历神经系统事件(例如癫痫发作和幻觉)的患者略少。
诺华需要进行随访研究,以长期评估治疗的安全性。
本文标题:FDA宣布美国首个基因疗法获批用于癌症治疗
地址:http://www.puerle.cn/health/20191102/250.html